Respuesta resumida:
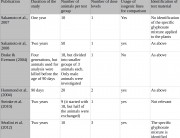
Séralini utilizó diez ratas de cada sexo por grupo: el mismo número de animales cuya composición química de sangre y orina analizó Monsanto en las pruebas de 90 días que supuestamente demostraban que los alimentos transgénicos son seguros. Este es el mismo número que la Organización de Cooperación y Desarrollo Económicos (OCDE) recomienda para las pruebas de toxicidad subcrónica de 90 días como las que Monsanto lleva a cabo en sus alimentos transgénicos, además de uno de sus protocolos de toxicidad crónica. Según los expertos en estadística, los grupos de este tamaño bastan para demostrar la toxicidad, pero no para demostrar la inocuidad. Esto significa que los estudios de toxicidad de la industria con este número de ratas que afirman demostrar la seguridad son insuficientes.
Respuesta detallada:
Los críticos afirman que Séralini utilizó muy pocos animales, y por lo tanto no se pueden extraer conclusiones de sus resultados. Sin embargo, Séralini utilizó el mismo número de animales (diez de cada sexo por grupo) cuya composición química de sangre y orina analizó Monsanto en las pruebas de 90 días sobre alimentos transgénicos comercializados, entre ellos su estudio del maíz NK603.1 2 3
Al parecer, los críticos de Séralini consideran que las pruebas con diez animales de cada sexo por grupo bastan para demostrar la seguridad pero no para demostrar los riesgos. Están aplicando una doble moral. Peor aún, han invertido el principio de cautela, que impone a la industria la carga de demostrar que sus productos son seguros. No corresponde a los científicos independientes ni al público demostrar que un producto es peligroso de forma satisfactoria para la industria y las autoridades reguladoras. Basta con demostrar que hay motivos de preocupación fundamentados científicamente.
Curiosamente, el número de ratas de cada grupo en los estudios de Monsanto era en realidad de 20 por sexo. Monsanto midió el peso de los órganos de las 20, pero solo informó de los análisis de composición química de sangre y orina de diez de ellas.1 2 3 No está claro cómo seleccionó Monsanto qué ratas analizar: puede que eligiera las ratas más sanas o aquellas cuyos órganos presentaran los mejores pesos. Esta práctica selectiva introduce la posibilidad de sesgo e invalida los resultados de Monsanto.
Algunos críticos afirman que diez ratas de cada sexo por grupo es un número aceptable para una prueba corta de 90 días, pero no es suficiente para un estudio de toxicidad crónica más largo. Sin embargo, el número de animales utilizados en los diferentes experimentos varía enormemente. Depende mucho de factores tales como la finalidad del experimento y los efectos (parámetros) examinados. Otro factor es hasta qué punto han minimizado los investigadores las variables del experimento, por ejemplo asegurándose de que los animales tienen la misma edad y peso. Cuando estos se controlan estrictamente pueden ser necesarios menos animales. Esto es así porque cualquier diferencia observada se deberá probablemente a la sustancia objeto de estudio.
Incluso los protocolos establecidos por la Organización de Cooperación y Desarrollo Económicos (OCDE) para las pruebas de seguridad de la industria varían ampliamente en cuanto al número de animales necesarios para el análisis:
- OCDE 408, el ensayo de alimentación en roedores de 90 días que Séralini decidió ampliar a un estudio a largo plazo, requiere diez animales de cada sexo por grupo.4 Ese es el número que utilizó Séralini.5 Es también el mismo número que Monsanto utilizó en sus análisis de composición química de sangre y orina para las pruebas de 90 días sobre OMG.1 2 3
- OCDE 453, el protocolo para estudios combinados de toxicidad crónica y carcinogenicidad, requiere diez animales de cada sexo por grupo para la fase de toxicidad crónica (el mismo número utilizado por Séralini), pero 50 de cada sexo por grupo para la fase de carcinogenicidad.6
- OCDE 452, el protocolo de toxicidad crónica, requiere 20 animales de cada sexo por grupo, pero solo los análisis de sangre y química clínica de diez de cada sexo por grupo.7
- OCDE 4518, el protocolo de carcinogenicidad, y la fase de carcinogenicidad del 453 requieren 50 animales de cada sexo por grupo.
Un punto importante, dada la controversia sobre qué conclusiones se pueden extraer del estudio de Séralini, es que el OCDE 453 advierte de que la interpretación de los resultados de la fase de toxicidad crónica se basa en el mayor número de animales (50 de cada sexo por grupo) en la fase de carcinogenicidad del experimento.
Séralini no contaba con los recursos para realizar un estudio de carcinogenicidad completo. Es por ello que no sacó conclusiones acerca de la carcinogenicidad y no llevó a cabo un análisis estadístico de los efectos en la incidencia de tumores o la mortalidad. Sencillamente se limitó a registrar los datos sobre la aparición y crecimiento de tumores en todos los grupos, de acuerdo con una práctica científica rigurosa y con los requisitos de la fase de toxicidad crónica del protocolo 453 de la OCDE.6
El hecho de que el estudio de Séralini no fuera un estudio de carcinogenicidad no significa que la aparición de tumores pueda ignorarse, como parecen exigir los críticos de Séralini.
Quienes defienden esta postura deben afrontar sus consecuencias lógicas. Lo que están recomendando es ignorar cualquier aparición de tumores detectada en un estudio de toxicidad crónica de la industria de acuerdo con el OCDE 453, con diez ratas de cada sexo por grupo, y permitir la comercialización del producto o sustancia estudiados.
El procedimiento más sensato es tener en cuenta los tumores detectados en la prueba de toxicidad crónica y exigir que se lleve a cabo un estudio completo de carcinogenicidad. Estos estudios de carcinogenicidad de dos años deben exigirse para todos los OMG antes de introducirlos en el suministro de piensos y alimentos.
Los expertos en estadística cuestionan el argumento de “muy pocas ratas”
El argumento de que Séralini utilizó un número de ratas demasiado pequeño para que sus hallazgos sobre la aparición de tumores sean estadísticamente significativos ha sido cuestionado por expertos en estadística.
Paul Deheuvels, experto en estadística de la Academia Francesa de Ciencias, afirmó que los resultados de Séralini “proporcionan pruebas lo bastante sólidas como para establecer la existencia de efectos tóxicos inesperados en productos que antes se consideraban seguros”.9
La opinión de Deheuvels fue respaldada por Peter Saunders, profesor emérito de matemáticas en el King College de Londres y experto en biología matemática. Saunders sostuvo que el bajo número de animales del estudio de Séralini hace que los resultados sean más convincentes, no menos. Esto se debe a que el uso de menos ratas reduce las probabilidades de observar algún efecto. Por lo tanto, el hecho de que Séralini detectara un aumento en la incidencia de tumores a pesar de haber utilizado un número relativamente pequeño de ratas hace que sus conclusiones tengan más solidez, y no menos, pues a menor número de ratas menor es la probabilidad de observar efectos tóxicos.10
Saunders afirmó que un mayor grupo de animales reduce las probabilidades de concluir erróneamente que el producto es seguro (un falso negativo), cuando en realidad tiene efectos cancerígenos. Esta es la razón por la que la OCDE insiste acertadamente en utilizar 50 animales de cada sexo por grupo para los estudios de carcinogenicidad: para evitar falsos negativos.
Saunders explicó:
“Si el experimento [de Séralini] no hubiera detectado carcinogenicidad, podría haberse debido a que los grupos eran demasiado pequeños. Pero dado que sí la detectó, el hecho de que los grupos fueran pequeños no supone un problema.”10
Respecto a las críticas de “expertos” al estudio de Séralini difundidas por el Science Media Centre, con sede en el Reino Unido,11 Saunders declaró:
“Los científicos que aportaron declaraciones para el Science Media Centre se apresuraron a objetar que Séralini y su grupo habían utilizado el protocolo para las pruebas de toxicidad en lugar del de carcinogénesis. Si hubieran dedicado un momento a preguntarse por qué los dos protocolos son diferentes, se habrían dado cuenta de que al utilizar el protocolo de toxicidad (y recordemos que esto fue así porque era el objeto del experimento) Séralini y su grupo redujeron sus posibilidades de detectar carcinogenicidad. Criticar el resultado porque el experimento se llevó a cabo de una manera más conservadora de lo necesario es totalmente injustificable.”10
Saunders y Deheuvels también señalaron la gran variedad de efectos detectados en los grupos de tratamiento y cómo se desarrollaron con el tiempo. Estos efectos, en su conjunto, indican un efecto tóxico real que es poco probable que se deba al azar o a variaciones aleatorias.9 12
Incluso la OCDE respalda la interpretación de Saunders y Deheuvels. En su directriz 116 sobre los estudios de carcinogenicidad y toxicidad crónica, se indica que el objetivo de utilizar un mayor número de animales es “aumentar la sensibilidad del estudio”; en otras palabras, evitar falsos negativos o errores de tipo II en los que se pasa por alto un efecto tóxico real.13 En el caso del estudio de Séralini, no hay ningún problema con la sensibilidad del estudio, puesto que se observaron efectos tóxicos en el tratamiento.
El Comité de carcinogenicidad (COC) del Ministerio de Salud británico, que investiga el correcto desarrollo de los estudios de carcinogenicidad en ratas, comparte esta opinión. El COC abordó la cuestión de las bajas tasas de supervivencia en algunas cepas de rata, que puede derivar en una situación en la que menos del 50% de las ratas sobreviven hasta el final de un experimento de dos años. Esto a su vez significa que un experimento puede acabar teniendo muchas menos ratas de las que se incluyeron en un principio, lo que reduce la solidez estadística a la hora de interpretar los resultados.
Sin embargo, lo más significativo es la puntualización del COC de que las bajas tasas de supervivencia son un problema en el caso de un resultado negativo: la conclusión de que la sustancia objeto del estudio es segura, no tóxica/cancerígena. Esto busca proteger a la población de declaraciones erróneas de la seguridad de una sustancia.
El COC afirma:
“Para que un resultado negativo [conclusión de que no hay efectos/inocuidad] a partir de un bioensayo de carcinogenicidad en ratas se considere aceptable, la supervivencia a los 24 meses debe ser del 50% o mayor en todos los grupos (véanse las directrices de la OCDE, la EPA y la UE)… La supervivencia en bioensayos de carcinogenicidad a largo plazo debe cumplir con las directrices actuales del Reino Unido y la Unión Europea para la aceptación de un resultado negativo en este tipo de estudios.”14
El COC no se ocupa del número de ratas supervivientes en los casos en que se detecta toxicidad, ya que en estos casos un número bajo no supone un problema.
Cabe destacar que el COC examinó estudios realizados con diferentes cepas de ratas, incluidas las del tipo Sprague-Dawley (SD) “de distintos orígenes”, para investigar si las ratas de determinadas cepas o procedencia presentaban tasas de supervivencia bajas, lo que podría poner en peligro la validez del experimento. Sin embargo, solo detectó una menor supervivencia en relación con las ratas SD criadas por Charles River. No mencionó las ratas SD de Harlan.
Dado que el objetivo del COC era aumentar la fiabilidad de los estudios de carcinogenicidad, si hubiera detectado algún problema con las tasas de supervivencia de las ratas SD proporcionadas por Harlan, es de suponer que lo habría indicado. Parece razonable concluir que el Comité determinó que las ratas SD de Harlan presentaban tasas de supervivencia aceptables.
De nuevo conviene recordar que el estudio de Séralini no era un estudio de carcinogenicidad, y que las ratas de control de Séralini (el número correcto, de acuerdo con el protocolo de toxicidad crónica 453 de la OCDE) tuvieron unas tasas de supervivencia superiores a las exigidas por las directrices de la OCDE. Solo el 30% de los machos y el 20% de las hembras de control murieron antes de que finalizara el experimento. Solo las ratas tratadas presentaron una mortalidad inusualmente elevada, de hasta el 50% en los machos y el 70% en las hembras antes de que finalizara el experimento, en algunos grupos cuya dieta contenían el maíz transgénico.
Por lo tanto, la recomendación de la OCDE de emplear un mayor número de ratas en los estudios de carcinogenicidad no se aplica al estudio de Séralini, porque:
- Su estudio no era un estudio de carcinogenicidad y él no sacó conclusiones sobre ese aspecto
- No llegó a una conclusión sobre la seguridad que pudiera haber sido un “falso negativo”, de modo que no hay necesidad de un número mayor de ratas en este caso
- Sus ratas de control presentaron tasas de supervivencia muy superiores al 50%, lo que significa una vez más que el requisito de la OCDE de utilizar un número mayor de ratas para evitar falsos negativos es irrelevante.
Las diferencias temporales son la clave
Un ex analista de investigación y experto en estadística de una importante agencia gubernamental, que prefiere permanecer en el anonimato, sostiene que el estudio de Séralini debe tomarse en serio. El analista afirma que los resultados no pueden desestimarse con el argumento de que los grupos de muestra son demasiado pequeños y que por ello el experimento tiene escasa solidez estadística.
Según dicho analista, el aspecto más importante de este estudio no son las tasas de mortalidad o de incidencia de tumores en las que se han centrado los críticos. En realidad, el aspecto más importante es el momento de aparición de todos los efectos en conjunto, que es lo que más destaca en la mayoría de los tratamientos en ambos sexos. Los grupos de tratamiento expuestos al maíz NK603 y/o al Roundup desarrollaron tumores y daños en los órganos mucho antes que los de control.
Esto contradice la idea de que los resultados se debieran al azar e indica que se debieron a las sustancias analizadas.
El analista declaró: “Las diferencias temporales me parecieron la clave, incluso aunque las ratas SD fueran propensas a los tumores, porque indican que el tratamiento, cuando menos, acelera la progresión del tumor. No observé el desarrollo de ninguna sensibilidad especial con el tiempo en las ratas SD cuando se usaron como control.”
El analista indicó que rechazar el conjunto de resultados por ser pequeño el tamaño de la muestra “no tiene justificación”. Concluyó: “En pocas palabras, algo ha ocurrido en este estudio que no se puede (o no se debe) ignorar. Mi conclusión es que las pruebas de seguridad de OMG deben evaluar toda la vida del organismo estudiado.”15
Conclusión lógica ante el argumento de “muy pocas ratas”
Si Monsanto y sus defensores quieren argumentar, basándose en la cantidad relativamente pequeña de animales utilizados en el experimento de Séralini, que todos los efectos tóxicos observados se debieron al azar, entonces Monsanto es libre de financiar un estudio de carcinogenicidad con un mayor número de animales. Tal experimento debe correr a cargo de científicos independientes con total transparencia. Pero mientras tanto, Monsanto no debe poder comercializar el maíz NK603 y el Roundup.
¿Quién debe financiar las pruebas de productos de la industria?
No se puede esperar que investigadores financiados con fondos públicos como Séralini cubran los enormes costes de las pruebas de seguridad a largo plazo para los productos de la industria, que pueden sumar millones. Dirk Detken, gerente de asuntos legales de la Autoridad Europea de Seguridad Alimentaria (EFSA), confirma que es responsabilidad de la industria demostrar la seguridad de sus productos.16 Monsanto debería haber llevado a cabo pruebas a largo plazo del NK603 y la formulación completa del Roundup (no solo el glifosato) para detectar carcinogenicidad y otros efectos negativos antes de solicitar autorización para comercializarlos.
Sin embargo, el que la industria pruebe sus propios productos puede suponer un problema. Las evaluaciones científicas que comparan los estudios realizados por la industria y por investigadores financiados públicamente en una variedad de productos problemáticos, desde el tabaco17 hasta los productos farmacéuticos18 pasando por los teléfonos móviles,19 han demostrado que los estudios de la industria están sesgados, y tienen tendencia a llegar a la conclusión de que el producto es seguro. Esto también ha resultado ser cierto para los estudios de OMG.20 21
Es por esto que no se debe permitir que la industria de los transgénicos pruebe sus propios productos, sino que debe contribuir a un fondo administrado públicamente para contratar a científicos independientes para probar el producto, dándoles instrucciones claras para proporcionar resultados de rigor científico.
Para que la investigación independiente pueda llevarse a cabo, la industria debe poner fin a su tendencia actual de no permitir a los investigadores el acceso a los materiales de prueba necesarios – el cultivo transgénico y la variedad no transgénica isogénica (genéticamente idéntica)22 23 24 – y debe ponerlos a su disposición para dichas pruebas.
Referencias:
1. Hammond B, Dudek R, Lemen J, Nemeth M. Results of a 13 week safety assurance study with rats fed grain from glyphosate tolerant corn. Food Chem Toxicol. Jun 2004; 42(6): 1003-1014.
2. Hammond B, Lemen J, Dudek R, et al. Results of a 90-day safety assurance study with rats fed grain from corn rootworm-protected corn. Food Chem Toxicol. Feb 2006; 44(2): 147-160.
3. Hammond BG, Dudek R, Lemen JK, Nemeth MA. Results of a 90-day safety assurance study with rats fed grain from corn borer-protected corn. Food Chem Toxicol. Jul 2006; 44(7): 1092-1099.
4. Organización de Cooperación y Desarrollo Económicos (OCDE). Directriz n.º 408 de la OECD para el estudio de sustancias químicas: Estudio de toxicidad oral de 90 días con dosis repetidas en roedores: aprobada el 21 de septiembre de 1998. 1998.
5. Séralini GE, Clair E, Mesnage R, et al. Long term toxicity of a Roundup herbicide and a Roundup-tolerant genetically modified maize (Toxicidad a largo plazo del herbicida Roundup y el maíz transgénico tolerante al Roundup) Food and Chemical Toxicology. Noviembre de 2012; 50(11): 4221-4231.
6. Organización de Cooperación y Desarrollo Económicos (OCDE). Directriz n.º 453 de la OCDE para el estudio de sustancias químicas: Carcinogenicidad/toxicidad crónica combinadas: aprobada el 7 de septiembre de 2009. 2009.
7. Organización de Cooperación y Desarrollo Económicos (OCDE). Directriz n.º 452 de la OCDE para el estudio de sustancias químicas: Estudios de toxicidad crónica: aprobada el 7 de septiembre de 2009. 2009. http://bit.ly/LxJT1Z
8. Organización de Cooperación y Desarrollo Económicos (OCDE). Directriz n.º 451 de la OCDE para el estudio de sustancias químicas: Estudios de carcinogenicidad: aprobada el 7 de septiembre de 2009. 2009.
9. Deheuvels P. Étude de Séralini sur les OGM: Pourquoi sa méthodologie est statistiquement bonne. Le Nouvel Observateur. 9 de octubre de 2012. http://bit.ly/RtPivG
10. Saunders P. Excess cancers and deaths with GM feed: The stats stand up. Science in Society. 16 de octubre de 2012.
11. Science Media Centre. Expert reaction to GM maize causing tumours in rats [comunicado de prensa]. 19 de septiembre de 2012. http://www.sciencemediacentre.org/pages/press_releases/12-09-19_gm_maize_rats_tumours.htm
12. Deheuvels P. L’étude de Séralini sur les OGM, pomme de discorde à l’Académie des sciences Le Nouvel Observateur. 19 de octubre de 2012. http://leplus.nouvelobs.com/contribution/661194-l-etude-de-seralini-sur-les-ogm-pomme-de-discorde-a-l-academie-des-sciences.html
13. Organización de Cooperación y Desarrollo Económicos (OCDE). Guidance document 116 on the conduct and design of chronic toxicity and carcinogenicity studies, supporting test guidelines 451, 452 and 453: 2nd edition: Environment directorate joint meeting of the chemicals committee and the working party on chemicals, pesticides and biotechnology. 13 de abril de 2012.
14. Ministerio de Salud (Reino Unido), Comité de carcinogenicidad de sustancias químicas presentes en los alimentos CPatE. Longevity in carcinogenicity studies in rats: Analysis of a database prepared by PSD: COC statement COC/00/S3. Abril de 2000. http://www.advisorybodies.doh.gov.uk/coc/longevity.htm
15. GMWatch. Comment on Seralini findings and statistics by former government analyst. 1 de octubre de 2012. http://www.gmwatch.org/latest-listing/51-2012/14249
16. Detken D. Intercambio de correos electrónicos con el Observatorio de las Corporaciones Europeas, 21 de diciembre. 2011.
17. Barnes DE, Bero LA. Why review articles on the health effects of passive smoking reach different conclusions. JAMA. 20 de mayo de 1998; 279(19): 1566-1570.
18. Lexchin J, Bero LA, Djulbegovic B, Clark O. Pharmaceutical industry sponsorship and research outcome and quality: systematic review. British Medical Journal. 2003; 326: 1167.
19. Huss A, Egger M, Hug K, Huweiler-Müntener K, Röösli M. Source of funding and results of studies of health effects of mobile phone use: Systematic review of experimental studies. Environmental Health Perspectives. Enero de 2007; 115: 1–4.
20. Diels J, Cunha M, Manaia C, Sabugosa-Madeira B, Silva M. Association of financial or professional conflict of interest to research outcomes on health risks or nutritional assessment studies of genetically modified products. Food Policy. 2011; 36: 197–203.
21. Domingo JL, Bordonaba JG. A literature review on the safety assessment of genetically modified plants. Environ Int. 4 de febrero de 2011; 37: 734–742.
22. Lotter D. The genetic engineering of food and the failure of science – Part 1: The development of a flawed enterprise. Int Jrnl of Soc of Agr & Food. 2007; 16(1): 31–49.
23. Lotter D. The genetic engineering of food and the failure of science – Part 2: Academic capitalism and the loss of scientific integrity. Int Jrnl of Soc of Agr & Food. 2008; 16(1): 50–68.
24. Scientific American. Do seed companies control GM crop research? 13 de agosto de 2009. http://www.scientificamerican.com/article.cfm?id=do-seed-companies-control-gm-crop-research
Fuentes de crítica:
Escritor científico Declan Butler, artículo en la revista Nature
http://www.nature.com/news/hyped-gm-maize-study-faces-growing-scrutiny-1.11566
Autoridad Europea de Seguridad Alimentaria
http://www.efsa.europa.eu/en/efsajournal/pub/2910.htm
http://www.efsa.europa.eu/en/efsajournal/pub/2986.htm